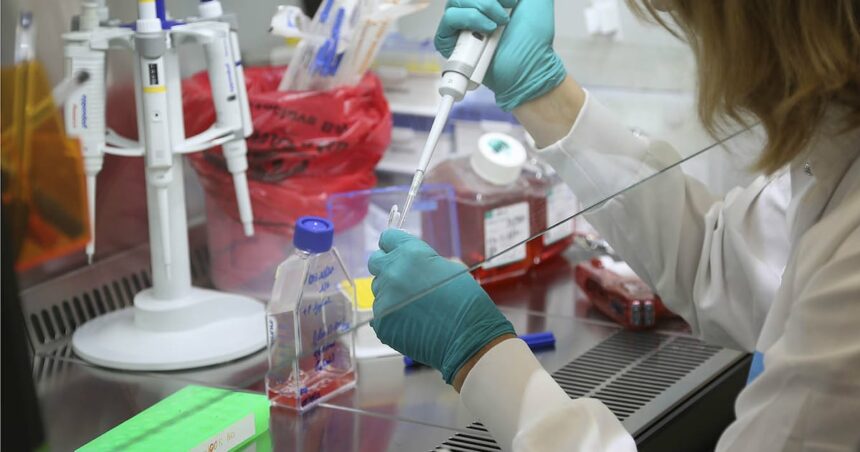
Sanofi a échoué sur le développement d’une molécule en phase III d’essais cliniques dans la sclérose en plaques primaire progressive. Ce candidat-médicament, sur lequel Sanofi comptait fortement, pourrait en revanche être approuvé dans la sclérose en plaques secondaire progressive non-récurrente.
Sanofi essuie un revers pour l’un de ses candidats-médicaments. Le laboratoire tricolore a annoncé le 15 décembre que le critère d’évaluation principal de sa molécule tolébrutinib dans le traitement de la sclérose en plaques primaire progressive (SEP-PP) n’avait pas été atteint. Ce développement clinique qui était en phase III s’arrête donc là, ce qu’a confirmé un porte-parole, Sanofi précisant par communiqué qu’il «ne poursuivra pas l’enregistrement réglementaire pour la SEP-PP».
En revanche, le groupe n’abandonne pas complètement cette molécule. Le tolébrutinib est en phase d’enregistrement dans le traitement de la sclérose en plaques secondaire progressive non-récurrente. Il est même déjà approuvé de façon provisoire aux Emirats arabes unis. Toutefois, Sanofi a aussi annoncé le 15 décembre que, dans cette indication, les délais d’examen du dossier réglementaire de ce médicament pourraient être allongés aux Etats-Unis.
Chute en bourse
Ces deux nouvelles n’ont pas vraiment séduit les investisseurs. Le prix de l’action a chuté, jusqu’à plus de 5% le matin de l’annonce avant de se stabiliser à un recul de l’ordre de 2,5% en fin de journée le 15 décembre. Alors que le groupe enchaîne les succès avec son médicament phare, le Dupixent, ce revers sur le tolébrutinib est forcément une déception. D’autant que cette molécule était présentée comme l’un des futurs relais de croissance.
En décembre 2023, ce candidat-médicament faisait partie de la liste des neuf nouveaux produits, vaccins inclus, qui devaient être lancés sur le marché entre 2024 et 2027 par Sanofi. Dans le cas du tolébrutinib, le laboratoire le classait parmi les plus valorisables, ceux disposant chacun de pics annuels de ventes attendus entre 2 et 5 milliards d’euros. Désormais, le laboratoire ne pourra plus compter que sur l’une des deux indications. En septembre dernier, le laboratoire avait aussi dévoilé des résultats qui avaient atteint les critères d’évaluation mais malgré tout jugés décevants pour un autre potentiel blockbuster, l’amlitelimab. Ce qui rappelle que le développement de médicaments reste une activité encore à haut risque. Actuellement, le taux d’attrition, donc d’échec, des programmes dépasse les 90% dans l’industrie pharmaceutique mondiale.